 ATP - Synthase - die kleinste Turbine der Welt
ATP - Synthase - die kleinste Turbine der Welt
In einem Wasserkraftwerk wird Wasser hinter einer Staumauer angestaut. Dieser Rückstau wird genutzt, um in Turbinen einer Rotation zu erzeugen, die in Stom umgwandelt wird. Dieses Wirkungsprinzip lässt sich als Analogie verwenden, um zu erklären, wie in Mitochondrien und Chloroplasten mittels ATP-Synthase chemische Energie in Form von ATP erzeugt wird. Angestaut werden hier Protonen, die Staumauer ist die innere Membran in die als "Turbine" die ATP-Synthase eingelassen ist. Der Mechanismus der ATP-Synthase beruht ebenfalls auf der einer Rotationsbewegung, die die ATP-Synthese antreibt. Man kann hier von einer molkularen Mechanik sprechen, die der Energiegewinnung dient.
Worum gehts?
Wie ist die ATP-Synthase aufgebaut?
Welcher funtionelle Zusammenhang besteht zwischen den Bauteilen?
Wie verläuft die Synthese von ATP an der inneren Mitochondrienmembran während der Endoxidation (Atmungskette)?
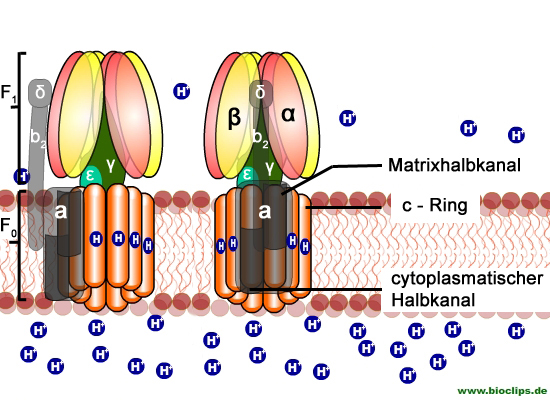
Aufbau der ATP – Synthase
Die F-1 Untereinheit
Die F1 Untereinheit besteht aus 5 unterschiedlichen Peptiden ( α, β, γ, δ und ε). Die jeweils drei α und β Untereinheiten bilden den Hauptanteil und sind abwechselnd angeordnet.
Nur die β-Untereinheiten sind direkt an der Katalyse beteiligt. Die γ- und ε-Untereiheiten bilden den zentralen Stiel.
Die F1 Untereinheit ragt in die Matrix.
Die F-0 Untereinheit
Die F0 Untereinheit ist der hydrophobe Teil, der in die Membran integriert ist. 10-14 c-Untereinheiten bilden einen Ring. Die a-Untereinheit ist an den Ring angelagert. Sie enthält zwei halbdurchlässige Protonenkanäle und bildet die Basis für die außen angelegt Säule, die über zwei b-Untereinheiten und eine δ-Untereinheit die Verbindung zum F1-Komplex herstellt.
 Was man im Folgenden wissen muss
Was man im Folgenden wissen muss
- Die ATP-Synthase lässt sich funktionell in eine bewegbliche Einheit, dem Rotor, und eine starre Einheit, dem Stator, einteilen.
- Der Rotor besteht aus dem c-Ring und dem zentraler (γ-ε-) Stiel.
- Der Stator besteht aus aus der Säule (a, δ- Protein sowie 2b-Proteinen) und jeweils 3 α- und β-Proteinen. Sie bilden sich abwechselnd ein Hexamer.
Zusammenhang von Struktur und Funktion bei der ATP - Synthase
Der Stator
Der Stator als starrer Komplex enthält die katalytische Einheit, die für die ATP - Synthese verantwortlich ist.
Über die Halbprotonenkanäle (A und B) des a-Proteins der Säule erfolgt der Protonentransport durch die Membran.
Der Kanal E (Eingang) nimmt Protonen auf und überträgt sie auf den Proteinring. Sie vollführen dann eine vollständige Rotation bis zum Kanal A (Ausgang), wo sie in die Matrix entlassen werden (Protonenfluss).
Der Rotor
Der Rotor ist das bewegliche Element der ATP-Synthase. Er besteht aus einem Protonenring und dem zentralen Stiel, der neben der Säule eine Verbindung zum Stator herstellt.
Der Protonenfluss versetzt den Proteinring in eine rotierende Bewegung, die den zentralen Stiel ebenfalls rotieren lässt.
Dadurch erfolgt die enzymatische Umsetzung der Substrat ADP und Posphat in das Produkt und vor allem die Freisetzung der ATP-Moleküle aus der Bindungstelle des Enzyms.
![]() Die ATP-Synthase besteht aus einer protonenleitenden und einer katalytischen Einheit.
Die ATP-Synthase besteht aus einer protonenleitenden und einer katalytischen Einheit.
Der Protonenstrom treibt die ATP - Synthese
Voraussetzung für die ATP-Synthese ist der Elektronentransport der Atmungskette durch die innere Mitochondrienmembran. Das führt zu einer Anreicherung von Protonen im Membranzwischenraum des Mitochondriums. Die Protonenkonzentration ist hier um ein Vielfaches höher als in der Matrix. Das Konzentrationsgefälle zwischen Membranzwischenraum und Matrix bezeichnet man als Protonengradient, der gleichzeitig einen elektrischen Gradienten (elektrisches Feld) enstehen lässt.
Ähnlich wie in der Analogie "Wasserkraftwerk" werden die Protonen durch die Membran (Staumauer) angestaut. Diese energiereiche Verteilung ergibt die sogenannte protonenmotorische Kraft, die im "Wasserkrafwerk" dem Wasserdruck entspricht.
Die Protonen sind nun bestrebt enstprechend dem Konzentrationsgefälle das Ungleichgewicht auszugleichen und fließen somit durch die Membran in Richtung Matrix, das können sie nur durch die ATP-Synthase, die hier als "Turbine" fungiert. Wie in einer wassergetriebenen Turbine wird in der ATP-Synthase der Rotor durch den Protonenstrom in eine rotierende Bewegung versetzt, der die ATP-Synthese antreibt. Wie wird nun genau die protonenmotorische Kraft umgesetzt, um chemische Energie in Form von ATP zu erzeugen.
Der "Protonendruck" wird über das protonenleitende Protein (Protein a der Säule) abgebaut. Die Protonen wandern über den cytoplasmatischen Halbkanal (E) ein und binden am Proteinring (c-Ring), der dadurch im Uhrzeigerrichtung in Rotation versetzt wird. Jedes Proton vollführt anschließend eine vollständige Rotation bis zum Matrixkanal (A). Hier erfolgt die Abgabe in die Matrix.
Wirkungsweise der Katalytischen Einheit der ATP-Synthase
Die Rotation des Proteinrings versetzt wiederum den zentralen Stiel (ε und γ - Komplex) in Rotation. Dadurch kommt es zu räumlichen Strukturänderungen der β-Proteine (Änderung der Konformation der katalytischen Proteine) ineinander. Das β-Protein kann drei Zustände einnehmen:
- L-Zustand: ADP und Phosphat wird fixiert
- T-Zustand: ATP-Synthese.
- O-Zustand: ATP wird freigesetzt.
Diese Konformationänderungen werden durch die Rotation des zentralen Stiels verursacht, der somit die Synthese und vor allem für die Freisetzung von ATP aus der Bindungsstelle des Enzyms veranlasst.
![]() Der Mechanismus der ATP-Synthese wurde erstmals als chemiosmotische Hypothese von Peter Mitchel im Jahr 1961 beschrieben. Sie formuliert, dass der Elektronentransport in der Atmungskette (Oxidation) und die ATP-Synthese (oxidative Phosphorylierung) durch einen Protonengradienten miteinander gekoppelt sind.
Der Mechanismus der ATP-Synthese wurde erstmals als chemiosmotische Hypothese von Peter Mitchel im Jahr 1961 beschrieben. Sie formuliert, dass der Elektronentransport in der Atmungskette (Oxidation) und die ATP-Synthese (oxidative Phosphorylierung) durch einen Protonengradienten miteinander gekoppelt sind.
Zusammenfassung
- Der Elektronentransport in der Atmungskette (Oxidation) und die ATP-Synthese (oxidative Phosphorylierung) sind durch einen Protonengradienten miteinander gekoppelt.
- Der Protonengradient setzt sich aus zwei Komponenten zusammen: einem chemischen (negativer pH-Wert im Membranzwischenraum) und einem elektrischen Gradienten (positive Ladung der Protonen).
- Die ATP-Synthase besteht aus einer protonenleitenden und einer katalytischen Einheit.
- Die "Mechanik" des Enzyms besteht aus einer starren (Stator) und einer rotierenden Einheit (Rotor).
- Die protonenmotorische Kraft (Gradient) versetzt den Rotor in eine Rotationsbewegung.
- Die Rotation des Rotors treibt die Konformationsänderungen der enzymatisch aktiven Proteine (β-Untereinheiten) und bewirkt somit die Katalyse und vor allem die Freisetzung von ATP.
![]() Das Wirkungsprinzip der ATP-Synthese während der Atmungskette (oxidative Phosphorylierung) entspricht der ATP-Synthese, wie sie bei der Lichtreaktion (Photophosphorylierung) abläuft. Bei der Photophosphorylierung entsteht der Protonengradient durch den lichtgetriebenen Elektronentransport.
Das Wirkungsprinzip der ATP-Synthese während der Atmungskette (oxidative Phosphorylierung) entspricht der ATP-Synthese, wie sie bei der Lichtreaktion (Photophosphorylierung) abläuft. Bei der Photophosphorylierung entsteht der Protonengradient durch den lichtgetriebenen Elektronentransport.