 Coenzyme der Flavoproteine
Coenzyme der Flavoproteine
Die meisten wasserstoffübertragenden Enzyme nutzen Nicotinamidnucleotide (NAD+, NADP+) als Cofaktoren (Coenzym, Cosubstrat) für die Wasserstoffübertragung. Das Enzymprotein (Apoenzym) und sein Coenzym gehen nur zum "Be- und Entladen" eine Verbindung (Holoenzym) ein.
Auch die nicht so häufig vorkommenden Flavoproteine bewältigen die Wasserstoffübertragung. Im Gegensatz zu den Nicotinamidnucleotiden kann sich bei den Flavoproteinen der Cofaktor nicht vom Enzymprotein lösen. Es ist als prosthetische Gruppe meistens über Wasserstoffbrücken oder hydrophobe Wechselwirkungen (Nebenvalenzen) mit dem Protein verbunden, auch kovalente Bindungen sind möglich, wenn auch seltener. Das gelbe Riboflavin ist ein zentraler Baustein der prosthetischen Gruppe, es enthält die reaktive Gruppe, das Redoxsystem.
Das Molekül muss als Vitamin der B2-Gruppe mit der Nahrung aufgenommen werden. Riboflavinmangel kann Entzündungformen der Haut und Anämie zur Folge haben.
Worum gehts?
Was sind Flavoproteine und was ist das besondere an ihrem "Coenzymen"?
Wie unterscheiden sich Coenzyme und wie verläuft die enzymatische Reaktion bei der Wasserstoffübertragung?
Die Glucose - Oxidase (GOD) enthält das Coenzym FAD als prosthetische Gruppe. Wie lässt sich mit diesem Enzym der Blutzuckerspiegel bestimmen?
Flavoproteine
- sind Enzymproteine, in denen der Cofaktor eines der Flavonucleotide FMN oder FAD fest im Molekül verankert ist (prosthetische Gruppe).
- gehören zu den Oxidoreduktasen und können somit in oxidierter und reduzierter Form vorliegen: Kontrolle von Redoxreaktionen.
- sind bei einer Vielzahl von Reaktionen beteiligt, wie z.B. die Vermittlung der Wasserstoff- und Elektronenübertragung zwischen Citratzyklus und Atmungskette durch die Succinat-Dehydrogenase oder NAD-Dehydrogenase (Mehr dazu weiter unten).
Flavonucleotide...
- bilden die prosthetische Gruppe der Flavoproteine.
- enthalten Riboflavin (Vitamin der B2-Gruppe) als Bestandteil des Cofaktors mit dem Redoxsystem.
- Riboflavin - 5´- phosphat (Flavomononucleotid; FMN) kommt eher selten vor.
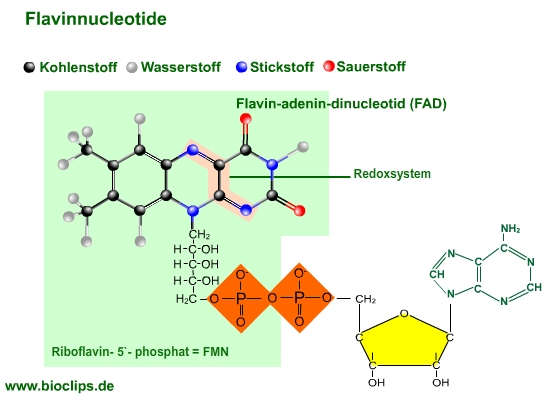
- Die meisten Flavoproteine enthalten Flavin-adenin-dinucleotid (FAD).
- Das reversible Redoxsystem (reaktive Gruppe) ist ein Isoalloxazin-System, das drei Zustände einnehmen kann:
- Chinon: oxidierter Zustand (siehe Abbildung)
- Semichinon: 1e- aufgenommen
- Hydrochinon: 2e- und 2H+ aufgenommen (reduziertes Flavin).
- Das Enzymprotein kann zwei Flavingruppen (z.B.: Glucose-Oxidase, GOD) pro Molekül enthalten: durch die Wechselwirkung zwischen den Gruppen kann der Semichinonzustand stabilisiert werden.
Flavinmononucleotid (FMN) als prosthetische Gruppe der NADH-Q-Oxidoreduktase
- Die NADH-Q-Oxidoreduktase (auch NADH - Dehydrogenase, Komplex I) katalysiert das Einschleusen der Elektronen vom NADH in die Atmungskette.
- Der Proteinkomplex enthält Flavinmononucleotid als prosthetische Gruppe.
Das Flavinmononucleotid (FMN) übernimmt zwei Elektronen in Form eines Hydridions (H- = 1H+ + 2e-) von NADH. Das FMNH- kann weiter zum FMNH2 protonisiert werden. Dabei wird NADH + H+ zu NAD+ oxidiert.
Vom FMNH2 werden anschließend die beiden Elektronen über ein semichinonartiges Intermediat auf eine Kette von Eisen-Schwefel-Zentren (FeS, Eisen-Schwefel-Cluster) übertragen.
Eine solche Umschaltung von Zwei-Elektronen-Donor auf einen Ein-Elektronen-Akzeptor ist die charakteristische Aufgabe von FMN und FAD.
Die Elektronen fließen über eine Kette von Eisen-Schwefel-Zentren und werden auf das lipohile Ubichinon (Coenzm Q) übertragen, welches in der inneren Mitochondrienmembran schwimmt.
Flavin - adenin - dinucleotid (FAD) als prosthetische Gruppe der Succinat-Q-Reduktase
Die Succinat-Q-Reduktase ist als Komplex II Bestandteil der Atmungskette und damit als integrales Protein fest in der inneren Mitochondrienmembran verankert. Der Komplex II überträgt Elektronen und H+ auf das Coenzym Q (Ubiochinon) ohne dabei Protonen in den Membranzwischenraum zu pumpen.
Der Enzymkomplex II besteht aus 4 Proteinuntereinheiten, wobei zwei dieser Proteine das Enzym Succinat-Dehydrogenase bilden. Die Dehydrogenase enthält FAD als prosthetische Gruppe, die kovalent mit einem Histidinrest des Proteins verbunden ist.
Das Enzym bindet auf der Matrixseite Succinat und katalysiert hier die Umsetzung zu Fumarat, wobei FADH2 entsteht.
Der Enzym ist das einzige membranintegrierte Enzym, das am Citratzyklus beteiligt ist. Es schleust gleichzeitig über FADH2 Elektroen und Protonen in die Atumgskette ein ohne dabei Protonen in den Intermembranraum des Mitochondriums zu überführen.
FADH2 wird in der Atumgskette oxidiert.
Im Enzym-Komplex befinden sich weiterhin Eisen-Schwefel-Zentren (Eisen-Schwefel-Cluster), die die Elektronen zum Coenzym Q (Ubichinon) weiterleiten. Sie fungieren hier als Elektronendonator.
FAD als prosthetische Gruppe der Glucose - Oxidase (GOD)
Aktuell sind etwa 6 Millionen Menschen in Deutschland an Diabetes erkrankt. Das sind mehr als 9 % der erwachsenen Bevölkerung. Die Dunkelziffer liegt wahrscheinlich höher, da sich die Krankheit schleichend entwickelt.
Betroffene Personen sind darauf angewiesen, ihren Blutzuckerspiegel genau zu kontrollieren. Die Glucosekonzentration im Blut direkt zu bestimmen ist schwierig, da Glucose farblos ist und deshalb nicht opitsch bestimmt werden kann. Deshalb kommt das Enzym Glucose-Oxidase (GOD) zum Einsatz. GOD oxidiert unter Sauerstoffverbrauch Beta-D-Glucose zu Gluconolacton. Der Sauerstoff wird dabei zu Wasserstoffperoxid reduziert. Durch die Substratspezifik des Enzyms wird im Blut ausschließlich Beta-D-Glucose umgesetzt, so dass sich über das Produkt Wasserstoffperoxid die Blutzuckermenge bestimmen lässt.
Bei der Reaktion werden zwei Elektronen und zwei Protonen über die prosthetische Gruppe FAD von der Glucose auf Sauerstoff übertragen.
In einer einzigen Sekunde setzt das Enzym 900 C6H12O2 und O2 um.
Es entsteht Gluconolacton und Wasserstoffperoxid. Auch Wasserstoffperoxid lässt sich optisch nicht sichtbar machen.
Deshalb kommt ein weiteres Enzym zum Einsatz, die Meerrettich - Peroxidase, die unter Verwendung von Wasserstoffperoxid ein farbloses Substrat in ein farbiges Produkt oxidiert. Die Konzentration des farbigen Produkts kann nun durch den optischen Test nach Warbug festgestellt werden.
 Weiterführende Literatur
Weiterführende Literatur
Müller-Esterl, Werner: Biochemie - Eine Einführung für Mediziner und Naturwissenschaftler.- 2. Auflage.- Spektrum Akademischer Verlag.- Heidelberg 2011
Renneberg, Reinhard: Bioanalytik für Einsteiger.- Spektrum Akademischer Verlag.- Heidelberg 2009
Stryer, Lubert; Tymoczko, John L.; Berg, Jeremy M.: Biochemie.- 7. Auflage.- Springer Verlag.- Berlin Heidelberg 2013