Insulinherstellung
Diabetes ist die Zivilisationskrankheit Nummer eins. Beim Typ I werden die Langerhans´schen Inseln durch das Immunsystem zerstört. Dieser Typ tritt vor dem 20. Lebensjahr auf. Beim Typ II (Altersdiabetes), der bei den meisten Diabetikern vorkommt, liegen zwar normale oder erhöhte Insulinspiegel im Blut vor, aber durch Veränderungen am Wirkort des Hormons, wird seine Funktionsfähigkeit herabgesetzt.
Der Bedarf an Insulin ist extrem hoch. Durch den Einsatz gentechnisch veränderter Bakterien lässt er sich heute leichter decken als früher. Vor dem Einsatz von Bakterien gewann man Insulin aus den Bauchspeicheldrüsen von Schweinen oder Rindern. Ein Diabetiker verbrauchte zur Deckung seines Jahresbedarfs Bauchspeicheldrüsen von ca. 50 Schweinen.
Worum gehts?
Es wird erläutert, welche zellinternen Vorgänge in den Beta-Zellen ablaufen, die zum aktiven Insulin führen.
Wie lässt sich mithilfe von Bakterien menschliches Insulin herstellen.
Insulin - Herstellung im Menschen
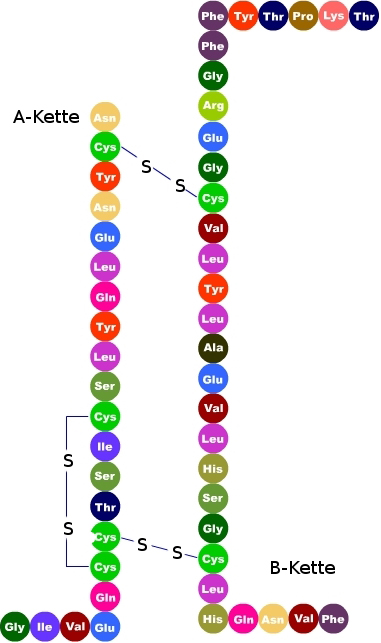
Insulin ist ein sehr kleines Hormon, das aus zwei Aminosäureketten (A- und B- Kette) besteht. Die A-Kette besteht aus 21 Aminosäuren, die B-Kette aus 30 Aminosäuren.
Beide Ketten werden zunächst als Bestandteil einer 110 AS langen Kette synthetisiert. Diese Langform ist das Präproinsulin.
24 Aminosäuren dieser Vorstufe signalisieren dem Endoplasmatischen Reticulum, es aufzunehmen. Bei der Aufnahme wird diese Signalsequenz abgespalten.
Die restlichen 86 Aminosäuren bilden das Proinsulin (A-, B- und C- Kette). A- und B-Kette treten über Disulfidbrücken (-S-S-) in Wechselwirkung.
Danach wird die C-Kette (C-Peptid) enzymatisch abgetrennt.
Das C-Peptid sorgt für eine räumlich korrekte Ausrichtung der A- und B- Kette (Ausbildung der Disulfidbrücken), nur so ist das Insulin funktionstüchtig.
Die Modifizierung einer Proteinvorstufe während oder nach der Translation bezeichnet man als Protein-Prozessierung.
Wie man mit E.coli menschliches Insulin erzeugt
Schritt 1
Die modifizierte Proinsulin-mRNA wird isoliert und durch die Reverse Transkriptase zu einem RNA-DNA-Hybrid synthetisiert.
Schritt 2
Mithilfe von DNA-Polymerase wird der DNA-Einzelstrang vervollständigt. Die cDNA ist fertig.
Schritt 3
An die Insulin-cDNA wird enzymatisch ein Startcodon (A: TAC für AUG → Methionin, Startcodon) sowie „klebrige Enden“ (B: sticky ends) angehängt.
Ergebnis
Die fertige „Passagier-DNA“ besteht somit aus den „klebrigen Enden“, dem Startcodon sowie dem Proinsulin-Gen für die B-, C-, A- Ketten.
Rekombinieren - Einbau in den Vektor
Die so gewonnene Fremd-DNA wird nun in den Vektor pBR322 eingebaut. Der Vektor enthält das Gen für Beta-Galactosidase und ein Gen für die Resistenz gegen Ampicillin.
Schritt 1
Durch Schneiden mit Eco RI soll der Einbau der Fremd-DNA mitten im Gen für Galactosidase erfolgen.
Schritt 2
Es entstehen „klebrige“ Enden, die zur Fremd-DNA komplementär sind.
Schritt 3
Durch die Wechselwirkung der „klebrigen“ Enden fügt sich die Fremd-DNA in das Plasmid ein.
Schritt 4
Die Lücken werden durch DNA-Ligasen geschlossen. Das rekombinierte Plasmid ist fertig.
Bedeutung des Operons für die Genexpression
Durch den Einbau des Proinsulin-Gens in das Galactosidase-Gen kann man das Lac-Operon für die Genexpression nutzen. Gleichzeitig schützt das Galactosidase-Protein den Insulinanteil vor zelleigenen Enzymen, den Proteasen, die vor allem kleinere Proteine sofort zerlegen.
![]() Moderne Verfahren verwenden zur Aufnahme des Proinsulin-Gens das Tryptophan-Synthase-Gen, das durch Enzymrepression kontrolliert wird. Das Typtophan-Operon enthält zusätzlich einen Mechanismus, der bei Trypthophanmangel die Genexpression verstärkt, was sich technisch gut nutzen lässt.
Moderne Verfahren verwenden zur Aufnahme des Proinsulin-Gens das Tryptophan-Synthase-Gen, das durch Enzymrepression kontrolliert wird. Das Typtophan-Operon enthält zusätzlich einen Mechanismus, der bei Trypthophanmangel die Genexpression verstärkt, was sich technisch gut nutzen lässt.
Transformieren – Selektieren - Klonieren
Das Einschleusen der Plasmide in E. coli erfolgt durch Transformation. Zur Selektion nutzt man die Ampicillin-Resistenz. Die Vermehrung der rekombinierten Bakterien erfolgt in Fermentern.
![]() Über eine längere Zeit wurden die Insulin-Ketten A und B aus Gründen der Sicherheit getrennt in zwei unterschiedlichen E. coli - Stämmen exprimiert, um auszuschließen, dass die Bakterien menschliches Insulin synthetisieren. So ausgestattete Bakterien würden, wenn sie in unseren Darm gelängen, einen Zuckerschock auslösen.
Über eine längere Zeit wurden die Insulin-Ketten A und B aus Gründen der Sicherheit getrennt in zwei unterschiedlichen E. coli - Stämmen exprimiert, um auszuschließen, dass die Bakterien menschliches Insulin synthetisieren. So ausgestattete Bakterien würden, wenn sie in unseren Darm gelängen, einen Zuckerschock auslösen.
Exprimieren - Modifizieren
Durch Zugabe von Lactose wird die Genexpression in Gang gesetzt. Das Beta-Galactosidase-Gen mit eingebautem Insulin-Gen wird exprimiert. Es entsteht ein Fusionsprotein aus Galactosidase und Proinsulin.
Das Genprodukt wird mittels Zentrifugation aus dem Nährmedium isoliert. Mit Bromcyan trennt man den Beta-Galactosidase-Teil vom Proinsulin, indem es die dafür eingebaute Aminosäure Methionin zerstört.
Das Proinsulin wird mit dem Enzym Trypsin zum Insulin modifiziert. Da die Bakterien nicht über das notwendige Enzym verfügen, muss es nach der Reinigung zugegeben werden.
Interferon-Herstellung durch Bakterien
Die Bedeutung der Expression menschlicher Gene in Wirtszellen (Bakterien, Hefen) wird auch an folgendem Beispiel Interferon deutlich. Als Wirkstoff bei der Behandlung von Krebs oder Multipler Sklerose war er vor der Herstellung mit gentechnisch veränderten Bakterien nur wenigen Menschen zugänglich. Interferon wurde bis dahin aus Blutzellen gewonnen. Für 400mg Interferon wurden 50 000 Liter Blut benötigt. Heute lässt es sich durch rekombinierte E. coli – Zellen in beliebiger Menge herstellen.