 Endoxidation - Atmungskette und oxidative Phosphorylierung
Endoxidation - Atmungskette und oxidative Phosphorylierung
Wer den ganzen Tag rumsitzt, verbraucht je nach Körpergewicht um die 1900kcal. Für die Bereitstellung dieser Energie werden ca. 80kg ATP benötigt. Der menschliche Körper verfügt aber nur über 250g ATP. Diese Diskrepanz muss der Stoffwechsel ausgleichen, indem er das verbrauchte ATP ständig aus ADP regeneriert. Ein ATP-Molekül durchläuft diesen „Aufbereitungsprozess“ ca. 300mal am Tag. Die Aufbereitung erfolgt letztendlich in der oxidativen Phosphorylierung als Teil der Endoxidation, die an einen Protonentransport durch die innere Mitochondrienmembran gekoppelt ist.
Worum gehts?
1. Wo befinden sich die Reaktionsorte der Atmungskette?
2. Ein Überblick über die Endoxidation zeigt den gesamten Ablauf und geht auf den Zusammenhang zwischen Atmungskette und oxidativer Phosphorylierung ein.
3. Wie verläuft der chemische Mechanismus innerhalb der beteiligten Membranproteine, die den Protonengradienten für die ATP-Synthese (oxidative Phosphorylierung) aufbauen.
4. Die Funktionsweise der oxidativen Phosphorylierung wird auf einer gesonderten Seite behandelt.
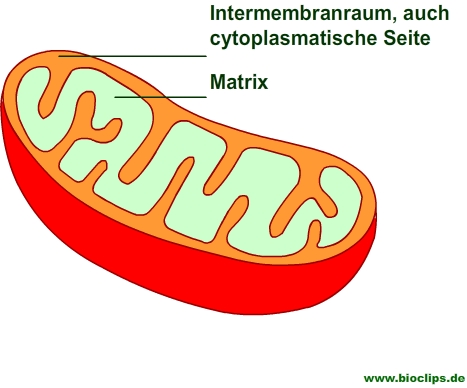
Die Endoxidation findet bei Eukaryonten in den Mitochondrien statt
- Mitochondrien sind ovale Organellen mit einer typischen Länge von ungefähr 2 μm und einem Durchmesser von 0,5 μm; dies entspricht etwa der Größe eines Bakteriums.
- Sie enthalten die Enzyme der oxidativen Decarboxylierung, des Citratzyklus, der Fettsäureoxidation und die Enzymkomplexe der Endoxidation.
- Mitochondrien sind von einer Doppelmembran umschlossen, sie besitzen somit eine äußere und eine innere Membran.
- Die innere Membran ist stark gefaltet.
- Es gibt also zwei Kompartimente in Mitochondrien:
- einen Intermembranraum zwischen äußerer und innerer Membran,
- die Matrix, die von der inneren Membran begrenzt wird. Die Matrix ist der Reaktionsort für die oxidative Decarboxylierung und den Citratzyklus.
- Die Endoxidation wird an der inneren Mitochondrienmembran durchgeführt, wobei man zwei miteinander gekoppelt Prozesse unterscheiden kann:
- die Atumungskette und
- die oxidative Phosphorylierung.
- Die äußere Membran ist für die meisten kleinen Moleküle und Ionen durchlässig, da es vie lMitochondrienporin gibt.
- Mitochondrienporin ist ein porenbildenden Protein, auch bekannt als VDAC (engl.: voltage dependent anion channel - spannungsabhängiger Anionenkanal).
- VDAC spielt eine Rolle beim geregelten Durchtritt von Zwischenprodukten – gewöhnlich anionischen Moleküle wie Phosphat, Chlorid, organischen Anionen und Adeninnucleotiden – durch die äußere Membran.
![]() Aufgrund der hohen Durchlässigkeit der äußeren Membran spricht man beim Intermembranraum auch von der cytoplasmatischen Seite.
Aufgrund der hohen Durchlässigkeit der äußeren Membran spricht man beim Intermembranraum auch von der cytoplasmatischen Seite.
 Wie groß ist die Membranoberfläche der Mitochondrien des Menschen?
Wie groß ist die Membranoberfläche der Mitochondrien des Menschen?
Beim Menschen umfasst die Fläche der inneren Mitochondrienmembran ungefähr 14.000m2, was ungefähr zwei Fußballfeldern entspricht. Damit sorgt die Einfaltung der inneren Mitochondrienmembran für eine extreme Vergrößerung der Oberfläche.
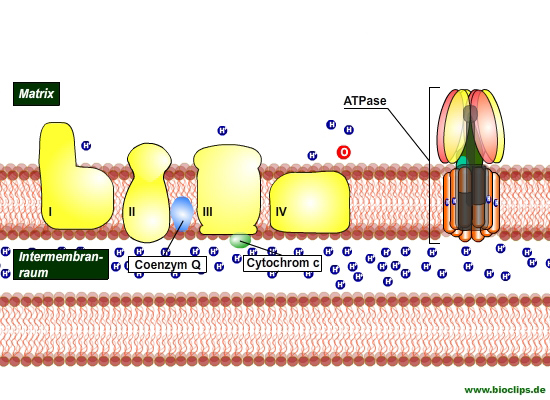
Die Atmungskette (Elektronentransportkette)
- Die Atmungskette besteht aus vier Membrankomplexen: drei Protonenpumpen und einem Enzymkomplex, der direkt am Citratzyklus beteiligt ist.
- Der Elektronenfluss innerhalb der Membrankomplexe I; III und IV bewirkt den Protonentransport von der Matrix in den Intermembranraum: Protonenpumpen.
- Spezifische Coenzyme (Elektronen-Carrier) transportieren Elektronen von einem Enzymkomplex zum nächsten.
- Die Atmungskette erzeugt einen Protonengradienten, der zur ATP-Synthese genutzt wird (Ankopplung der Phosphorylierung)
Enzymkomplexe
Komplex I: NADH-Q-Oxidoreduktase (NAD-Dehydrogenase)
- bindet NADH und übernimmt 2 energiereiche Elektronen
- diese werden auf das Coenzym Q (Ubichinon) übertragen
- das führt zur reduzierten Form von Q (QH2; Ubichinol)
- der Elektronenfluss pumpt 4H+ in den Intermembranraum
- QH2 übergibt die Elektronen an den Komplex III
Komplex II: Succinat-Q-Reduktase - Elektronen vom FADH2
- Elektronen werden auf das Coenzym Q übertragen.
- Die Succinat-Q-Reduktase ist keine Protonenpumpe: deshalb weniger ATP durch FADH2.
 Die Succinat-Q-Reduktase und die Beteiligung am Citratzyklus
Die Succinat-Q-Reduktase und die Beteiligung am Citratzyklus
- Der Komplex II enthält das Enzym Succinat-Dehydrogenase.
- Diese katalysiert im Citratzyklus Succinat zu Fumarat. Dabei entsteht FADH2.
- Sie ist als prosthetische Gruppe fest im Komplex II integriert und ist somit das einzige Enzym des Citratzyklus, das in der inneren Membran lokalisiert ist. FADH2 bleibt im Proteinkomplex.
Komplex III: Q-Cytochrom-c-Oxidoreduktase
- katalysiert die Elektronenübertragung von der reduzierten Form des Coenzyms Q (QH2, Ubichinol) auf das oxidierte Cytochrom c.
- Dadurch werden 2H+ in den Intermembranraum gepumpt.
Komplex IV: Cytochrom-c-Oxidase
- katalysiert den Elektronenfluss vom reduzierten Cytochrom c zur Reduktion von molekularen Sauerstoff zu Wasser
- Für die Reduktion werden H+ aus der Matrix verbraucht.
- Gleichzeitig werden 4 H+ aus der Matrix in den Intermembranraum gepumpt.
Coenzym - Q (Ubichinon) und Cytochrom c sind spezifische Elektronen-Carrier
- Sie transportieren die Elektronen von einem Membrankomplex zum nächsten.
- bewegen sich aufgrund ihrer lipophilen Eigenschaften frei innerhalb der Membran.
Coenzym Q (Ubichinon) - Q-Pool
- ist ein Chinonderivat, das in drei Oxidationszuständen existieren kann
- Coenzym Q (Ubichinon, oxidierte Form)
- Coenzym QH2 (Ubichinol, reduzierte Form)
- Elektronentransport von NADH-Q-Oxidoreduktase zur Q-Cytochrom-c-Oxidoreduktase
- aufgrund seiner Löslichkeit nimmt man an, dass in der inneren Mitochondrienmembran ein Pool von Q und QH2 existiert. Die Gesamtheit von Q und QH2 bezeichnet man als Q-Pool.
Cytochrom c
- kleines lösliches, elektronenübertragendes Protein
- enthält ein Häm als prosthetische Gruppe
- Elektronentransport von Elektronen der Q-Cytochrom-c-Oxidoreduktase zur Cytochrom-c-Oxidase
Elektronenfluss und Pumpmechanismen der Membrankomplexe
Eintritt der energiereichen Elektronen in die Atmungskette über die NADH-Q-Oxidoreduktase
- Elektronen mit hohem Potential werden von NADH an die NADH-Q-Oxidoreduktase übergeben
- Im ersten Schritt erfolgt die Bindung von NADH und die Übertragung zweier Elektronen hohen Potentials auf das Flavinmononucleotid (FMN), das zu FMNH2 reduziert wird.
- Die Elektronen werden dann vom FMNH2 auf eine Reihe von Eisen-Schwefel-Komplexen übertragen.
- In der NADH-Q-Oxidoreduktase liegen sowohl 2Fe-2S als auch 4Fe-4S-Komplexe vor.
- Die Eisenatome in diesen Fe-S-Komplexen wechseln zwischen zwei Zustanden:
- Fe2+ (reduziert) - Elektron aufgenommen
- Fe3+ (oxidiert) - Elektron abgegeben
- Elektronen werden letzendlich auf das Coenzym Q übertragen
- das führt zur Aufnahme von 2 H+ aus der Matrix
- QH2 verlässt das Enzym in Richtung des hydrophoben Membraninneren (Q-Pool).
- die Oxidations-Reduktions-Reaktionen der Eisen-Schwefel-Komplexe bewirken den Transport von 4H+ in den Intermembranraum.
Ergebnis und Bedeutung
- Bilanz: NADH + Q + 5H+Matrix => NAD+ + QH2 + 4H+Cytoplasma
- Energiereiche Elektronen der werden in die Atmungskette eingeschleust.
- 4 Protonen werden in den Intermembranraum gepumpt.
Elektronenübernahme der Q-Cytochrom-c-Oxidoreduktase und die Reduktion des Cytochrom c
- koppelt den Elektronentransfer von Q zu Cytochrom c mit dem Protonentransport durch die Membran
- Die Oxidoreduktase enthält zwei unterschiedliche Arten von Cytochromen mit drei Häm-Gruppen:
- Cytochrom b mit den Häm-Typen:
- Typ 1: Häm bL(L für niedrige, engl.: low, Elektronenaffinität)
- Typ 2: Häm bH (H für hohe, engl.: hight, Elektronenaffinität)
- Cytochrom c1 mit einer einer Häm - Gruppe
- Cytochrom b mit den Häm-Typen:
- Zusätzlich zu den Häm-Gruppen enthält das Enzym ein Eisen-Schwefel-Protein mit einem 2Fe-2S-Zentrum (auch Rieske - Zentrum genannt)
Q-Zyklus
- als Erstes bindet ein QH2
- es werden 2 Eletronen und zwei Protonen freigesetzt
- die Elektronen gehen jetzt unterschiedliche Wege:
- über die Häme der Cytochrome b wird ein e- auf ein gebundenes Qoxi überrtragen, dadurch entsteht ein Semichinonradikal-Ion
- das andere e- wird über das 2Fe-2S-Zentrum und Cytochrom c1 auf Cytochrom c übertragen
- Der Vorgang wiederholt sich nun, indem ein zweites QH2 bindet und 2e- auf das Semichinonradikal bzw. Cytochrom c1 verteilt.
- Es entsteht ein zweites reduziertes Cytochrom sowie ein QH2, das dem Q-Pool zugeführt wird.
 Cytochrome
Cytochrome
- elektronenübertragende Proteine mit einem Häm als prosthetische Gruppe
- Eisenionen wechseln während des Elektronentransports zwischen:
- Fe3+oxi (Ferri) und Fe2+red (Ferro) - Form
- Die Cytochrome b, c1 und c enthalten Eisen-Protoporphyrin IX als prosthetische Gruppe der Häme. Sie enthalten somit die gleichen Häm-Gruppen wie Myoglobin und Hämoglobin.
- Diese identischen Häme besitzen unterschiedliche Affinintäten zur Elektronen, weil ihre Umgebung im Polypeptid unterschiedlich ist.
Ergebnis und Bedeutung
- Bilanz: 2QH2 + 2Cyt coxi + 2H+Matrix => Q + QH2 + 2Cyt cred + 4H+Cytoplasma
- 4 H+ gelangen in den Intermembranraum, 2H+ werden aus der Matrix entfernt
- zwei Coenzyme QH2 werden oxidiert, wobei ein Coenzym Q reduziert und dem Q-Pool zugeführt wird
- Das Enzym verteilt die Elektronen effektiv von einem Zwei-Elektronen-Transporter (Coenzym Q) auf einen Ein-Elektronen-Transporter (Cytochrom c)
Übernahme der Elektronen durch die Cytochrom-c-Oxidase und die Reduktion von Sauerstoff zu Wasser
- Cytochrom-c-Oxidase besitzt:
- 2 Häm A Gruppen
- Häm a
- Häm a3
- 3 Kupferzentren:
- CuA/CuA
- CuB
- Kupferionen wechseln durch Elektronenauf- bzw. -abgabe zwischen Cu+ (reduziert, Cupro-Form) und Cu2+ (oxidiert, Cupri-Form)
- 2 Häm A Gruppen
- Häm a3 und CuB bilden das aktive Zetrum für die Reduktion von Wasser
Reduktion von Wasser
- Das Kupferzentrum CuA/CuA nimmt die Elektronen von 2 Cytochrom c - Coenzymen auf
- Ein Elektron fließt CuB, das andere zum Häm a3 (Reduktion)
- Bindung vonO2 zieht die Elektronen aus Fe2+ und CuBred ab
- es kommt zur Ausbildung einer Peroxid (O22-) - Brücke
- 2 Cytochrom c - Moleküle binden und setzen wiederum 2 Elektronen frei die zum aktiven Zetrum wandern
- Addition eines Elektrons und Protons führt zur Ausbildung von zwei Ion-Sauerstoff-Gruppen (Cub2+-OH und Fe3+-OH)
- Die Rekation mit zwei weiteren Protonen führt zur Freisetzung von Wasser
- Protonen (chemische) stammen aus der Matrix und sind somit ein Beitrag zum Protonengradienten
Protonenpumpe
- während der Reduktion von Sauerstoff werden 4 weitere Protonen in den Intermembranraum gepumpt
- Effekte die zum Pumpmechachanismus beitragen:
- die Addition eines Elektrons begünstigt die Bindung eines Protons in benachbarten Bereichen
- durch den Zyklus bedingte Konformationveränderung ("Formveränderung") des Proteinkomplexes bewirkt, dass die Protonen in einer Konformation aus der Matrix in das Protein eintreten, aber das Protein nur in einer anderen Konformation in Richtung Intermembranraum verlassen können.
Ergebnis und Bedeutung
- Bilanz: 4Cyt cred + 8H+Matrix + O2 => 4Cyt coxi + 2H2O + 4H+Cytoplasma
- Reduktion von Sauerstoff zu Wasser, die dafür notwendigen Protonen werden aus der Matrix entfernt, was zu einer Erhöhung der Protonengradienten beiträgt
- 4 Protonen werden in den Intermembranraum gepumpt.
Oxidative Phosphorylierung
![]() Die Atmungskette wandelt die Energie der Elektronen in eine protonenmotorische Kraft. Dieser Protonengradienten treibt die ATP-Synthese, die oxidative Phosphorylierung, an. Der Membrankomplex der für ATP-Synthese verantwortlich ist, ist die ATP-Synthase, die kleinste Turbine der Welt.
Die Atmungskette wandelt die Energie der Elektronen in eine protonenmotorische Kraft. Dieser Protonengradienten treibt die ATP-Synthese, die oxidative Phosphorylierung, an. Der Membrankomplex der für ATP-Synthese verantwortlich ist, ist die ATP-Synthase, die kleinste Turbine der Welt.